පරමාණුක වර්ණාවලි 2
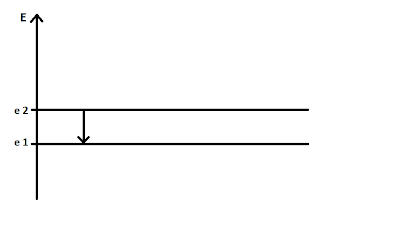
මෙහි e1 හා e2 යනු අනුයාත ශක්ති අගයන් 2ක් යයි ගනිමු. බෝර් සඳහන් කරන්නේ ඉලෙක්ට්රෝනයක් e1 හෝ e2 වැනි නිශ්චිත ශක්ති අගයක පවතින බවයි. එනම් මම මෙහි තිරස්ව ඇඳ ඇති එක් එක් ඉරක් බෝර්ගේ ශක්ති මට්ටමකි.
මෙහි එන "ක්වොන්ටීකරනය" යන වදනට ඔබ බිය විය යුතු නැත. එය මෙසේය. මැක්ස් ප්ලාන්ක් පවසන පරිදි ශක්තිය අංශු අංශු ලෙස පවතී. එම නිසා ශක්ති(E) අක්ෂයේ අනුයාත ශක්ති අගයන් දෙකක් සම්පූර්ණයෙන් වෙන් වී පවතී. එනම් මෙහි මම පෙන්වන එක ඉරක් පෙන්වන්නේ ශක්ති පරාසයක් නොව එක් ශක්ති අගයක් පමණකි. "ක්වොන්ටීකරනය වී ඇත" යන්නේ අදහස එයයි. එම නිසා ඉලෙක්ට්රෝනයක් මෙම ශක්ති මට්ටමක පවතින තාක් එහි ශක්තිය නොවෙනස් ව පවතී.
ඉහත දෑ පැවසූ සැණකින් ඔබට දෙවෙනි වගන්තියේ පැවසූ දෙය වැටහෙන්නට ඇති. කරුණාකර මෙය තවත් ප්රස්තාරයක් ලෙස පමණක් සලකන්න. මෙහි e2 මට්ටමේ ශක්තිය > e1 මට්ටමේ ශක්තිය බව බැලූ පමණින් ඔබට සිතා ගත හැකිය. එම නිසා e1 පවතින ඉලෙක්ට්රෝනයක් e2 ශක්ති මට්ටමට යාමට නම් එයට ශක්තිය අවශ්ය වේ. එම නිසා ශක්තිය ලබාගෙන ඉලෙක්ට්රෝනයකට ඉහළ ශක්ති මට්ටමකට ළඟා විය හැකිය.
එමෙන්ම එහි ඇති ශක්තියෙන් කොටසක් පිට කර පහළ ශක්ති මට්ටමකට යාමේ හැකියාවද ඉලෙක්ට්රෝනයට පවතී.( ප්රස්තාරයට අනුව සිතන්න ).
ඉහත දක්වා ඇති තෙවන වගන්තිය බෝර් විසින් පවසා ඇත්තේ රයිඩ්බර්ග් සමීකරණය සලකායි. එය පැහැදිලි කිරීමට රයිඩ්බර්ග් සමීකරණය අවශ්ය වන නිසා එය පමණක් දත්තයක් ලෙස මතක තබා ගැනිම යෝග්ය වේ.
මැක්ස් ප්ලාන්ක් සඳහන් කරන ලද පරිදි ක්වොන්ටම් අංශු පැකැට්ටුවක ( ක්වොන්ටාවක ) ශක්තිය E නම්,
E= hf වේ. මෙහි h යනු ප්ලාන්ක්ගේ නියතයයි. h = 6.62606957(29)×10−34
දැන් අපි e2 ශක්ති මට්ටමේ ඇති ඉලෙක්ට්රෝනයක් ශක්තිය පිටකර e1 ශක්ති මට්ටමට ගියේ යයි සිතමු.
2. බාමර් ශ්රේණිය
3. පාශන් ශ්රේණිය
4. බ්රැකට් ශ්රේණිය
හයිඩ්රජන් වල සමස්ත වර්ණාවලිය පහත පරිදි වේ.
මෙහි දෘශ්ය කලාපයට ඇතුළත් වන්නේ බාමර් ශ්රේණිය පමණි. එම නිසා අපට පියවි ඇසට පෙනෙන හයිඩ්රජන් වර්ණාවලිය ඉහත කොටසේ සාකච්ඡා කල වර්ණාවලිය වේ.
මෙය ඇති වන ආකාරය අපි විමෝචන වර්ණාවලියකින් පැහැදිලි කර ගනිමු.
මෙහි ඔබ දැන ගත යුතු විශේෂ කරුණු කිහිපයකි.
මැක්ස් ප්ලාන්ක් ට අනුව E = hf නිසා වැඩිම සංඛ්යාතයක් සහිත තරංගයට අදාළ ක්වොන්ටා නිකුත් කරන්නේ වැඩිම ශක්ති වෙනසක් සහිතව ශක්ති මට්ටම් අතර හුවමාරු වන ඉලෙක්ට්රෝනයයි. එසේ වැඩිම ශක්ති අන්තරයක් ඇත්තේ පළමුවෙනි ශක්ති මට්ටම හා අනන්තය වැනි ශක්ති මට්ටම අතරයි.
එම නිසා හයිඩ්රජන් වර්ණාවලියේ වැඩිම සංඛ්යාතය ඇති රේඛාව වන්නේ ලයිමාන් ශ්රේණියේ අනන්තය වැනි ශක්ති මට්ටමේ සිට පළමුවෙනි ශක්ති මට්ටමට ඉලෙක්ට්රෝනය චලනය වීම නිසා ඇති වන රේඛාවයි.
f ∝ 1/තරංග ආයාමය නිසා අවම තරංග ආයාමය ඇත්තේ ද මෙම රේඛාවටම වේ.
කතෘ අයිතිය රජිත රාමනායක සතු ය.
පරමාණුක වර්ණාවලි 1 ලිපියෙන් ඔබ පරමාණුක වර්ණාවලි ගැන මූලික අවබෝධයක් ලබා ගෙන ඇතැයි මම සිතමි. මෙම ලිපිය යටතේ අපි පරමාණුක වර්ණාවලි ඇතිවීම ගැන සහ හයිඩ්රජන් හි පරමාණුක වර්ණාවලිය ගැන අධ්යනය කරමු.
1913 දී නීල්ස් බෝර්, මැක්ස් ප්ලාන්ක් හා ජොහැන්ස් රයිඩ්බර්ග් ගේ සොයාගැනිම් අනුව යමින් පරමාණුක වර්ණාවලි ඇති වීම පැහැදිලි කිරීම සඳහා නව පරමාණුක ආකෘතියක් ඉදිරිපත් කරන ලදී. එය නව පරමාණුක අකෘතියක් සේ හැදින්වූවත් එය රදර්ෆර්ඩ් ගේ පරමාණුක ආකෘතියේම විකරණයක් ලෙස මට හැඟේ.
සත්ය වශයෙන් පැවසුවොත් නීල්ස් බෝර් රදර්ෆර්ඩ් ට වඩා කරුණු කිහිපයක් සඳහන් කරයි. එවා නම්,
1. පරමාණුවක ඉලෙක්ට්රෝන ක්වොන්ටණීකරනය වූ නිශ්චිත ශක්ති මට්ටම් වල පවතී.එම ශක්ති මට්ටමේ සිටින තාක් එය ශක්තිය අවශෝෂණය හෝ විමෝචනය නොකරයි.
2. ඉලෙක්ට්රෝනයකට ශක්තිය ලබා ගනිමින් ඉහළ ශක්ති මට්ටමකට ත් ශක්තිය පිට කරමින් පහළ ශක්ති මට්ටමකට ත් ගමන් කළ හැකිය.
3. ඉලෙක්ට්රෝන පැවතිය හැකි ශක්ති මට්ටම් වල ශක්ති අගය වැඩිවන විට එම ශක්ති මට්ටම් අතර ශක්ති පරතරය අඩු වේ.
මේවා කියවූ සැණින් ඔබට නොවැටහුණි නම් එය අරුමයක් නොවේ. මන්ද මෙය ගැඹුරු සිංහල වහරක් භාවිතයෙන් ප්රකාශ කර ඇති නිසාය. බොහෝ අය මෙවැනි අසීරු සිංහල වදන් කට පාඩම් කිරීමට ගොසින් අමාරුවේ වැටී "පරමාණුක වර්ණාවලි නම් එපා වෙනවා. ගොඩක් පාඩම් කරන්න තියනවානෙ" යයි පවසයි. මාගේ උපදේශය නම් පාඩම් කිරීමට ප්රථම ඔබ පාඩම් කරන දෙය අවබෝධ කර ගත්තා නම් මෙහි පාඩම් කිරීමට ඇති දෙයක් නැති බව ඔබටම වැටහේවි.
අපි බෝර් ගේ ශක්ති මට්ටම් සංකල්පය පැහැදිලි කර ගනිමු. මුලින්ම පහත රූපයේ පරිදි ශක්ති ප්රස්තාරයක් ඇඳීමට සූදානම් වෙන පරිදි සිරස්ව ශක්ති(E) අක්ෂයක් ඇඳ ගනිමු.
මෙහි e1 හා e2 යනු අනුයාත ශක්ති අගයන් 2ක් යයි ගනිමු. බෝර් සඳහන් කරන්නේ ඉලෙක්ට්රෝනයක් e1 හෝ e2 වැනි නිශ්චිත ශක්ති අගයක පවතින බවයි. එනම් මම මෙහි තිරස්ව ඇඳ ඇති එක් එක් ඉරක් බෝර්ගේ ශක්ති මට්ටමකි.
මෙහි එන "ක්වොන්ටීකරනය" යන වදනට ඔබ බිය විය යුතු නැත. එය මෙසේය. මැක්ස් ප්ලාන්ක් පවසන පරිදි ශක්තිය අංශු අංශු ලෙස පවතී. එම නිසා ශක්ති(E) අක්ෂයේ අනුයාත ශක්ති අගයන් දෙකක් සම්පූර්ණයෙන් වෙන් වී පවතී. එනම් මෙහි මම පෙන්වන එක ඉරක් පෙන්වන්නේ ශක්ති පරාසයක් නොව එක් ශක්ති අගයක් පමණකි. "ක්වොන්ටීකරනය වී ඇත" යන්නේ අදහස එයයි. එම නිසා ඉලෙක්ට්රෝනයක් මෙම ශක්ති මට්ටමක පවතින තාක් එහි ශක්තිය නොවෙනස් ව පවතී.
ඉහත දෑ පැවසූ සැණකින් ඔබට දෙවෙනි වගන්තියේ පැවසූ දෙය වැටහෙන්නට ඇති. කරුණාකර මෙය තවත් ප්රස්තාරයක් ලෙස පමණක් සලකන්න. මෙහි e2 මට්ටමේ ශක්තිය > e1 මට්ටමේ ශක්තිය බව බැලූ පමණින් ඔබට සිතා ගත හැකිය. එම නිසා e1 පවතින ඉලෙක්ට්රෝනයක් e2 ශක්ති මට්ටමට යාමට නම් එයට ශක්තිය අවශ්ය වේ. එම නිසා ශක්තිය ලබාගෙන ඉලෙක්ට්රෝනයකට ඉහළ ශක්ති මට්ටමකට ළඟා විය හැකිය.
එමෙන්ම එහි ඇති ශක්තියෙන් කොටසක් පිට කර පහළ ශක්ති මට්ටමකට යාමේ හැකියාවද ඉලෙක්ට්රෝනයට පවතී.( ප්රස්තාරයට අනුව සිතන්න ).
ඉහත දක්වා ඇති තෙවන වගන්තිය බෝර් විසින් පවසා ඇත්තේ රයිඩ්බර්ග් සමීකරණය සලකායි. එය පැහැදිලි කිරීමට රයිඩ්බර්ග් සමීකරණය අවශ්ය වන නිසා එය පමණක් දත්තයක් ලෙස මතක තබා ගැනිම යෝග්ය වේ.
අවශෝෂණ වර්ණාවලිය ඇති වන ආකාරය පැහැදිලි කිරීම.
මැක්ස් ප්ලාන්ක් සඳහන් කරන ලද පරිදි ක්වොන්ටම් අංශු පැකැට්ටුවක ( ක්වොන්ටාවක ) ශක්තිය E නම්,
E= hf වේ. මෙහි h යනු ප්ලාන්ක්ගේ නියතයයි. h = 6.62606957(29)×10−34
ඉහත සඳහන් කල උදාහරණයම අපි ගනිමු. ඉලෙක්ට්රෝනයක් විද්යුත් චුම්බක තරංග වල ශක්තිය ලබාගෙන e1 ශක්ති මට්ටමේ සිට e2 ශක්ති මට්ටමට ගියේ යයි සිතමු.
ඉලෙක්ට්රෝනය ලබා ගත් ශක්තිය = e2 - e1
මෙය ඉලෙක්ට්රෝනය ලබා ගන්නේ ක්වොන්ටා එකකිනි. ඉලෙක්ට්රෝනය ලබා ගත් එම ක්වොන්ටාවේ සංඛ්යාතය f නම්,
e2 -e1 = hf
f = (e2-e1) / h
ඉලෙක්ට්රෝනයේ මෙම ශක්ති වැඩිවීම සඳහා සැම විටකම ශක්තිය ලබා ගන්නේ ඉහත සංඛ්යාතයෙන් යුතු "ක්වොන්ටා" වලින් පමණි.
සංයෝගයේ ඇති මෙම ඉලෙක්ට්රෝන මගින් මෙම සංඛ්යාතයෙන් යුතු ක්වොන්ටා අවශෝෂණය කරන බැවින් මෙය හරහා ගොස් පිටවී යන විද්යුත් චුම්බක තරංග වල මෙම සංඛ්යාතය දක්නට නොලැබේ. එම නිසා මෙය හරහා ගොස් පිටවී යන විද්යුත් චුම්බක තරංගය විභේදනය කර බැලූ විට මෙම සංඛ්යාතයට අදාළ වර්ණය දක්නට නොලැබෙන අතර එම වර්ණය තිබිය යුතු ස්ථානය අඳුරු පැහැයෙන් තිබේ.
විමෝචනය වර්ණාවලිය ඇති වන ආකාරය පැහැදිලි කිරීම.
දැන් අපි e2 ශක්ති මට්ටමේ ඇති ඉලෙක්ට්රෝනයක් ශක්තිය පිටකර e1 ශක්ති මට්ටමට ගියේ යයි සිතමු.
ඉලෙක්ට්රෝනය පිට කල ශක්තිය = e2-e1
මෙය ඉලෙක්ට්රෝනය පිට කරන්නේ ක්වොන්ටා එකකිනි. ඉලෙක්ට්රෝනය පිට කල එම ක්වොන්ටාවේ සංඛ්යාතය f නම්,
සංයෝගයේ ඇති මෙම ඉලෙක්ට්රෝන මගින් මෙම සංඛ්යාතයෙන් යුතු ක්වොන්ටා විමෝචනය කරන බැවින් මෙයින් පිට කරන විද්යුත් චුම්බක තරංග වල මෙම සංඛ්යාතය දක්නට ලැබේ. එම නිසා මෙයින් පිට කරන විද්යුත් චුම්බක තරංගය විභේදනය කර බැලූ විට මෙම සංඛ්යාතයට අදාළ වර්ණය දක්නට ලැබේ. ( විමෝචන වර්ණාවලි ගැන පරමාණුක වර්ණාවලි 1 ලිපියෙහි අඩංගු කරුණු සලකන්න. )
හයිඩ්රජන් වල අවශෝෂණ වර්ණාවලිය පහත දැක්වේ.
මෙය ඇති වන්නේ n2 ශක්ති මට්ටමේ ඇති ඉලෙක්ට්රෝන තමන් හරහා යන විද්යුත් චුම්බක තරංග වලින් ශක්තිය ලබාගෙන ඉහළ ශක්ති මට්ටම් වලට යාමෙනි.
හයිඩ්රජන් වායුවට රත් කර හෝ පුළිඟු පැන්නවීමෙන් ලබා දෙන ශක්තිය හේතුවෙන් එහි H පරමාණුවල භූමිගත අවස්ථාවේ පවතින ඉලෙක්ට්රෝන ඉහළ ශක්ති මට්ටම් වලට යයි. නමුත් එය අස්ථායී තත්වයක් නිසා එම ඉලෙක්ට්රෝන නැවත පහළ ඇති ශක්ති මට්ටම් වලට පැමිණේ. මෙසේ ඉහළ ශක්ති මට්ටම් වල සිට n2 ශක්ති මට්ටමට පැමිණෙන ඉලෙක්ට්රෝන නිසා මෙම විමෝචන වර්ණාවලිය සෑදේ.
මෙය ඉලෙක්ට්රෝනය පිට කරන්නේ ක්වොන්ටා එකකිනි. ඉලෙක්ට්රෝනය පිට කල එම ක්වොන්ටාවේ සංඛ්යාතය f නම්,
e2 -e1 = hf
f = (e2-e1) / h
ඉලෙක්ට්රෝනයේ මෙම ශක්ති වැඩිවීම සඳහා සැම විටකම පිට කරන්නේ ඉහත සංඛ්යාතයෙන් යුතු "ක්වොන්ටා" වලින් පමණි.
සංයෝගයේ ඇති මෙම ඉලෙක්ට්රෝන මගින් මෙම සංඛ්යාතයෙන් යුතු ක්වොන්ටා විමෝචනය කරන බැවින් මෙයින් පිට කරන විද්යුත් චුම්බක තරංග වල මෙම සංඛ්යාතය දක්නට ලැබේ. එම නිසා මෙයින් පිට කරන විද්යුත් චුම්බක තරංගය විභේදනය කර බැලූ විට මෙම සංඛ්යාතයට අදාළ වර්ණය දක්නට ලැබේ. ( විමෝචන වර්ණාවලි ගැන පරමාණුක වර්ණාවලි 1 ලිපියෙහි අඩංගු කරුණු සලකන්න. )
හයිඩ්රජන් වර්ණාවලිය ගැන අධ්යනය
හයිඩ්රජන් පරමාණුවේ ඇති ප්රධාන ශක්ති මට්ටම් n1, n2, n3, .... ලෙසද, එම ශක්ති මට්ටම් වල ශක්තිය e1, e2, e3, .... ලෙසද ලකුණු කර ගනිමු.
හයිඩ්රජන් වල අවශෝෂණ වර්ණාවලියට අදාල ඉලෙක්ට්රොනික සංක්රමණ
හයිඩ්රජන් වල අවශෝෂණ වර්ණාවලිය පහත දැක්වේ.මෙය ඇති වන්නේ n2 ශක්ති මට්ටමේ ඇති ඉලෙක්ට්රෝන තමන් හරහා යන විද්යුත් චුම්බක තරංග වලින් ශක්තිය ලබාගෙන ඉහළ ශක්ති මට්ටම් වලට යාමෙනි.
හයිඩ්රජන් විමෝචන වර්ණාවලියට අදාල ඉලෙක්ට්රොනික සංක්රමණ
හයිඩ්රජන් වල විමෝචන වර්ණාවලිය පහත දැක්වේ.හයිඩ්රජන් වායුවට රත් කර හෝ පුළිඟු පැන්නවීමෙන් ලබා දෙන ශක්තිය හේතුවෙන් එහි H පරමාණුවල භූමිගත අවස්ථාවේ පවතින ඉලෙක්ට්රෝන ඉහළ ශක්ති මට්ටම් වලට යයි. නමුත් එය අස්ථායී තත්වයක් නිසා එම ඉලෙක්ට්රෝන නැවත පහළ ඇති ශක්ති මට්ටම් වලට පැමිණේ. මෙසේ ඉහළ ශක්ති මට්ටම් වල සිට n2 ශක්ති මට්ටමට පැමිණෙන ඉලෙක්ට්රෝන නිසා මෙම විමෝචන වර්ණාවලිය සෑදේ.
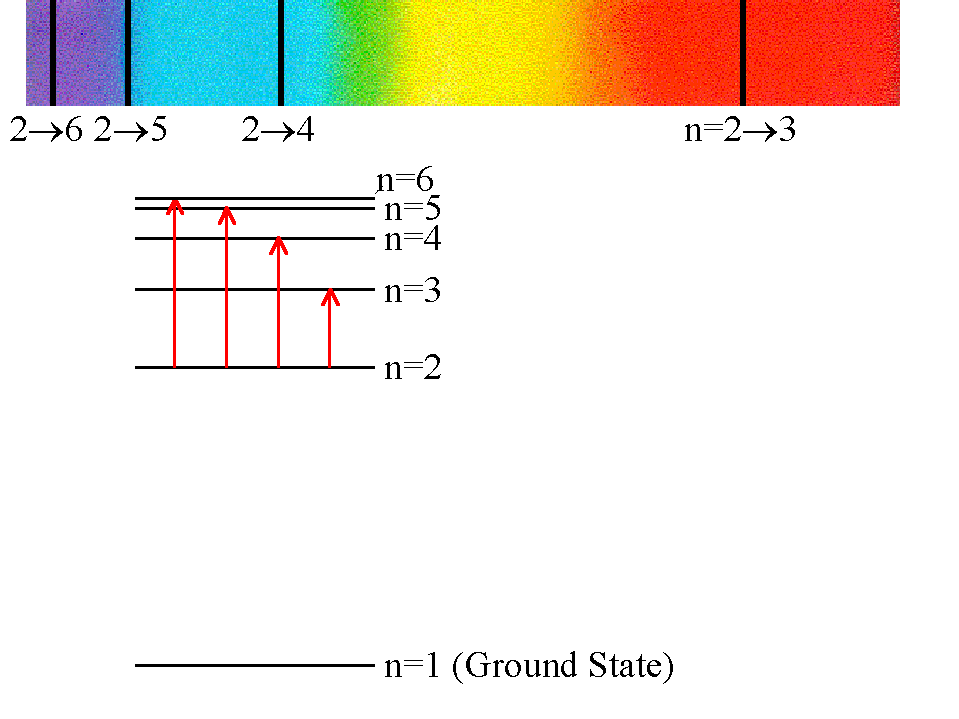
හයිඩ්රජන් සමස්ත වර්ණාවලිය
හයිඩ්රජන් හි සමස්ත වර්ණාවලියේ අපට වැදගත් වන ශ්රේණි 4ක් පවතී.
1. ලැයිමාන් ශ්රේණිය2. බාමර් ශ්රේණිය
3. පාශන් ශ්රේණිය
4. බ්රැකට් ශ්රේණිය
හයිඩ්රජන් වල සමස්ත වර්ණාවලිය පහත පරිදි වේ.
මෙහි දෘශ්ය කලාපයට ඇතුළත් වන්නේ බාමර් ශ්රේණිය පමණි. එම නිසා අපට පියවි ඇසට පෙනෙන හයිඩ්රජන් වර්ණාවලිය ඉහත කොටසේ සාකච්ඡා කල වර්ණාවලිය වේ.
මෙය ඇති වන ආකාරය අපි විමෝචන වර්ණාවලියකින් පැහැදිලි කර ගනිමු.
මෙහි ඔබ දැන ගත යුතු විශේෂ කරුණු කිහිපයකි.
මැක්ස් ප්ලාන්ක් ට අනුව E = hf නිසා වැඩිම සංඛ්යාතයක් සහිත තරංගයට අදාළ ක්වොන්ටා නිකුත් කරන්නේ වැඩිම ශක්ති වෙනසක් සහිතව ශක්ති මට්ටම් අතර හුවමාරු වන ඉලෙක්ට්රෝනයයි. එසේ වැඩිම ශක්ති අන්තරයක් ඇත්තේ පළමුවෙනි ශක්ති මට්ටම හා අනන්තය වැනි ශක්ති මට්ටම අතරයි.
එම නිසා හයිඩ්රජන් වර්ණාවලියේ වැඩිම සංඛ්යාතය ඇති රේඛාව වන්නේ ලයිමාන් ශ්රේණියේ අනන්තය වැනි ශක්ති මට්ටමේ සිට පළමුවෙනි ශක්ති මට්ටමට ඉලෙක්ට්රෝනය චලනය වීම නිසා ඇති වන රේඛාවයි.
f ∝ 1/තරංග ආයාමය නිසා අවම තරංග ආයාමය ඇත්තේ ද මෙම රේඛාවටම වේ.
කතෘ අයිතිය රජිත රාමනායක සතු ය.
රෑප සටහන් අවසරයකින් තොරව උපුටා නොගන්න. කතෘ අයිතිය සුරකින්න.